關(guān)于新型冠狀病毒感染肺炎疫情下,廣東企業(yè)援助疫情抗擊工作、轉(zhuǎn)產(chǎn)口罩生產(chǎn)之法律指引(第2期)
(第2期)
???????2020年1月30日,中華人民共和國(guó)國(guó)家衛(wèi)生健康委員會(huì)疾病預(yù)防控制局(下稱“國(guó)家衛(wèi)健委疾控局”)發(fā)布《預(yù)防新型冠狀病毒感染的肺炎口罩使用指南》,明確口罩是預(yù)防呼吸道傳染病的重要防線,可以降低新型冠狀病毒感染風(fēng)險(xiǎn)。國(guó)家衛(wèi)健委疾控局推薦的口罩類型及使用對(duì)象主要包括:
一、一次性使用醫(yī)用口罩:推薦公眾在非人員密集的公共場(chǎng)所使用。
二、醫(yī)用外科口罩:防護(hù)效果優(yōu)于一次性使用醫(yī)用口罩,推薦疑似病例、公共交通司乘人員、出租車司機(jī)、環(huán)衛(wèi)工人、公共場(chǎng)所服務(wù)人員等在崗期間佩戴。
三、KN95/N95及以上顆粒物防護(hù)口罩:防護(hù)效果優(yōu)于醫(yī)用外科口罩、一次性使用醫(yī)用口罩,推薦現(xiàn)場(chǎng)調(diào)查、采樣和檢測(cè)人員使用,公眾在人員高度密集場(chǎng)所或密閉公共場(chǎng)所也可佩戴。
四、醫(yī)用防護(hù)口罩:推薦發(fā)熱門診、隔離病房醫(yī)護(hù)人員及確診患者轉(zhuǎn)移時(shí)佩戴。
作為重要的疫情防控物資,口罩一時(shí)間被搶購(gòu)一空;在庫(kù)存供應(yīng)短缺的情況下,許多地市、醫(yī)院都出現(xiàn)“一罩難求”的局面,嚴(yán)重影響了疫情抗擊工作的正常進(jìn)行。為應(yīng)對(duì)市面上口罩供不應(yīng)求的現(xiàn)狀,各地紛紛出臺(tái)政策,鼓勵(lì)企業(yè)轉(zhuǎn)產(chǎn)包括口罩在內(nèi)的疫情防控應(yīng)急物資。筆者現(xiàn)以廣東省為例,從法律角度向企業(yè)介紹如何轉(zhuǎn)產(chǎn)口罩生產(chǎn),以支援疫情抗擊工作。
國(guó)家衛(wèi)健委疾控局推薦的四類口罩中:一次性使用醫(yī)用口罩的執(zhí)行標(biāo)準(zhǔn)為YY/T0969—2013,醫(yī)用外科口罩的執(zhí)行標(biāo)準(zhǔn)為YY 0469—2011,醫(yī)用防護(hù)口罩的執(zhí)行標(biāo)準(zhǔn)為GB 19083—2010,均屬第二類醫(yī)療器械;KN95/N95及以上顆粒物防護(hù)口罩屬于非醫(yī)用口罩,執(zhí)行標(biāo)準(zhǔn)為GB 2626—2006。
本文主要分析基于國(guó)家衛(wèi)健委疾控局推薦的上述四類口罩按照“非醫(yī)用”、“醫(yī)用”兩個(gè)類別給與建議。企業(yè)的生產(chǎn)實(shí)踐中,除國(guó)家衛(wèi)健委疾控局推薦的口罩類別外,亦可根據(jù)當(dāng)?shù)丶膊】刂祁A(yù)防中心關(guān)于口罩的使用推薦、結(jié)合企業(yè)自身生產(chǎn)條件,考慮選擇生產(chǎn)其他標(biāo)準(zhǔn)的防護(hù)口罩。
?
第一部分 開展非醫(yī)用顆粒物防護(hù)口罩生產(chǎn)所需資質(zhì)
?
一、非醫(yī)用顆粒物防護(hù)口罩的性質(zhì)
N95是美國(guó)國(guó)家職業(yè)安全衛(wèi)生研究所(NationalInstitute for Occupational Safety and Health)認(rèn)證的9種顆粒物防護(hù)口罩的型號(hào)之一種,只要非油性顆粒物過(guò)濾效率達(dá)到95%以上的口罩都可以稱之為N95口罩。KN95口罩是經(jīng)我國(guó)《中華人民共和國(guó)國(guó)家標(biāo)準(zhǔn):呼吸防護(hù)用品自吸過(guò)濾式防顆粒物呼吸器(GB2626-2006代替GB2626-1992,GB/T6223-1997,GB/T6224.1-6224.4-1986)》標(biāo)準(zhǔn)認(rèn)證的口罩中的一種,二者對(duì)于非油性顆粒物的過(guò)濾效率標(biāo)準(zhǔn)一致。
由于醫(yī)用防護(hù)口罩適用GB19083—2010的執(zhí)行標(biāo)準(zhǔn),該標(biāo)準(zhǔn)要求非油性顆粒過(guò)濾效率達(dá)到至少95%以上(其中1級(jí)≥95%,2級(jí)≥99%,3級(jí)≥99.97%),因此醫(yī)用防護(hù)口罩一般符合KN95/N95標(biāo)準(zhǔn),屬于醫(yī)用類型的KN95/N95及以上口罩,根據(jù)最新版《醫(yī)療器械分類目錄》屬于第二類醫(yī)療器械。除該等醫(yī)用防護(hù)口罩外,其它執(zhí)行GB2626-2006《呼吸防護(hù)用品自吸過(guò)濾式防顆粒物呼吸器》標(biāo)準(zhǔn)生產(chǎn)的顆粒物防護(hù)口罩系非醫(yī)用類型口罩,不屬于醫(yī)療器械。我們理解國(guó)家衛(wèi)健委疾控局在《預(yù)防新型冠狀病毒感染的肺炎口罩使用指南》所述KN95/N95及以上顆粒物防護(hù)口罩即為該類執(zhí)行GB2626-2006標(biāo)準(zhǔn)生產(chǎn)的非醫(yī)用類型口罩(下稱“非醫(yī)用顆粒物防護(hù)口罩”)。根據(jù)《特種勞動(dòng)防護(hù)用品目錄》,該等非醫(yī)用顆粒物防護(hù)口罩屬于特種勞動(dòng)防護(hù)用品。
?二、生產(chǎn)非醫(yī)用顆粒物防護(hù)口罩所需證照及監(jiān)管要求
國(guó)務(wù)院于2019年9月頒布《關(guān)于調(diào)整工業(yè)產(chǎn)品生產(chǎn)許可證管理目錄加強(qiáng)事中事后監(jiān)管的決定》,取消了特種勞動(dòng)防護(hù)用品的工業(yè)產(chǎn)品生產(chǎn)許可證管理,因此,企業(yè)生產(chǎn)非醫(yī)用顆粒物防護(hù)口罩不再需要申請(qǐng)工業(yè)產(chǎn)品生產(chǎn)許可證(QS認(rèn)證)。與生產(chǎn)非醫(yī)用防護(hù)口罩相關(guān)的監(jiān)管/認(rèn)證程序僅為:
(一)??須向市場(chǎng)監(jiān)督管理局申請(qǐng)辦理工商變更登記
企業(yè)轉(zhuǎn)產(chǎn)非醫(yī)用顆粒物防護(hù)口罩生產(chǎn)的,需根據(jù)《中華人民共和國(guó)公司法》第十二條的規(guī)定就經(jīng)營(yíng)范圍的改變進(jìn)行工商變更登記,增加“特種勞動(dòng)防護(hù)用品制造”(具體以市場(chǎng)監(jiān)督管理局核定為準(zhǔn))的經(jīng)營(yíng)范圍,企業(yè)需提供變更登記備案申請(qǐng)書、修改后的公司章程、關(guān)于修改公司章程的決議/決定及營(yíng)業(yè)執(zhí)照原件。企業(yè)還可向當(dāng)?shù)厥袌?chǎng)監(jiān)督管理局確認(rèn)是否存在相關(guān)應(yīng)急通道便于企業(yè)在疫情防護(hù)期間加速辦理該類工商變更登記,根據(jù)筆者了解,很多地市均可通過(guò)網(wǎng)絡(luò)當(dāng)天辦結(jié)。
(二)??建議同步申請(qǐng)?zhí)胤N勞動(dòng)防護(hù)用品安全標(biāo)志認(rèn)證(LA標(biāo)志認(rèn)證)
《勞動(dòng)防護(hù)用品監(jiān)督管理規(guī)定》第六條規(guī)定:“特種勞動(dòng)防護(hù)用品實(shí)行安全標(biāo)志管理。”;《特種勞動(dòng)防護(hù)用品安全標(biāo)志實(shí)施細(xì)則》第二條規(guī)定:“特種勞動(dòng)防護(hù)用品安全標(biāo)志是確認(rèn)特種勞動(dòng)防護(hù)用品安全防護(hù)性能符合國(guó)家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn),準(zhǔn)許生產(chǎn)經(jīng)營(yíng)單位配發(fā)和使用該勞動(dòng)防護(hù)用品的憑證。”但《勞動(dòng)防護(hù)用品監(jiān)督管理規(guī)定》和《特種勞動(dòng)防護(hù)用品安全標(biāo)志實(shí)施細(xì)則》分別于2015年7月1日、2016年2月4日被廢止,且現(xiàn)行有效的《中華人民共和國(guó)安全生產(chǎn)法》也未提及關(guān)于特種勞動(dòng)防護(hù)用品安全標(biāo)志的認(rèn)證規(guī)定。經(jīng)筆者向特種勞動(dòng)防護(hù)用品安全標(biāo)志管理中心(下稱“安標(biāo)中心”)電話咨詢,工作人員口頭答復(fù)確認(rèn)特種勞動(dòng)保護(hù)防護(hù)用品自2015年起已不要求經(jīng)過(guò)LA標(biāo)志認(rèn)證,但表示有的采購(gòu)方仍然要求產(chǎn)品具有LA標(biāo)志認(rèn)證安全標(biāo)志,安標(biāo)中心也仍然在進(jìn)行LA標(biāo)志認(rèn)證工作。經(jīng)檢索,廣東省內(nèi)的自吸過(guò)濾式防顆粒物呼吸器生產(chǎn)企業(yè)廣州市保為康勞保用品有限公司、四會(huì)市金富裕工業(yè)保健用品有限公司和廣州市冠樺勞保用品有限公司以及3M中國(guó)有限公司等多家企業(yè)至今仍持續(xù)維持LA標(biāo)志認(rèn)證。
因此,為保障口罩產(chǎn)品的質(zhì)量、提高市場(chǎng)信賴度,轉(zhuǎn)產(chǎn)企業(yè)可考慮申辦LA標(biāo)志認(rèn)證。安標(biāo)中心規(guī)定:生產(chǎn)自吸過(guò)濾式防顆粒物呼吸器類別下的隨棄式面罩的申請(qǐng)單位應(yīng)必備如下主要生產(chǎn)設(shè)備和檢測(cè)儀器設(shè)備:
1、生產(chǎn)設(shè)備:壓力成型設(shè)備或超聲波焊接設(shè)備或縫紉設(shè)備;
2、檢測(cè)儀器設(shè)備:呼吸阻力測(cè)試裝置、過(guò)濾效率測(cè)試裝置。生產(chǎn)有閥防顆粒物呼吸器的企業(yè)還應(yīng)具備呼氣閥氣密性測(cè)試裝置。
安標(biāo)中心官網(wǎng)公示的初次申辦特種勞防用品安全標(biāo)志認(rèn)證的流程如下:
(1)申請(qǐng):申請(qǐng)單位向安標(biāo)中心提交申請(qǐng)材料。
(2)初審與受理:安標(biāo)中心對(duì)申請(qǐng)材料進(jìn)行初審,符合要求的,向申請(qǐng)單位發(fā)出受理通知書;不符合要求的,申請(qǐng)單位按要求補(bǔ)充申請(qǐng)材料。初審時(shí)間為5個(gè)工作日。
(3)技術(shù)審查:申請(qǐng)被受理后,安標(biāo)中心組織審查人員對(duì)申請(qǐng)產(chǎn)品的技術(shù)文件進(jìn)行審查,并提出技術(shù)審查報(bào)告。技術(shù)審查合格的,安標(biāo)中心發(fā)出現(xiàn)場(chǎng)評(píng)審?fù)ㄖ獣患夹g(shù)審查不合格的,向申請(qǐng)單位發(fā)出整改通知。申請(qǐng)單位應(yīng)在接到整改通知之日起30日內(nèi)完成整改,逾期未完成整改或整改后仍不合格的,終止本次特種勞動(dòng)防護(hù)用品安全標(biāo)志申辦。技術(shù)審查時(shí)間為10個(gè)工作日。
(4)現(xiàn)場(chǎng)評(píng)審:技術(shù)審查合格的,安標(biāo)中心向申請(qǐng)單位發(fā)出“現(xiàn)場(chǎng)評(píng)審?fù)ㄖ獣保蛟u(píng)審人員發(fā)出“現(xiàn)場(chǎng)評(píng)審任務(wù)書”,對(duì)申請(qǐng)單位的主體資格、技術(shù)力量、生產(chǎn)設(shè)備、檢測(cè)檢驗(yàn)設(shè)備和管理體系等條件進(jìn)行現(xiàn)場(chǎng)評(píng)審,提出現(xiàn)場(chǎng)評(píng)審報(bào)告。現(xiàn)場(chǎng)評(píng)審?fù)瓿珊螅u(píng)審組向企業(yè)通報(bào)評(píng)審情況,宣布評(píng)審結(jié)論,對(duì)現(xiàn)場(chǎng)評(píng)審中發(fā)現(xiàn)的不符合項(xiàng)提出整改要求。申請(qǐng)單位應(yīng)在30日內(nèi)對(duì)不符合項(xiàng)完成整改,整改報(bào)告經(jīng)評(píng)審組長(zhǎng)審核后,交安標(biāo)中心。
(5)產(chǎn)品檢驗(yàn):現(xiàn)場(chǎng)評(píng)審?fù)ㄟ^(guò),評(píng)審人員按照特種勞動(dòng)防護(hù)用品安全標(biāo)志抽樣有關(guān)要求抽封樣品,填寫特種勞動(dòng)防護(hù)用品安全標(biāo)志抽樣單,申請(qǐng)單位應(yīng)于封樣之日起5日內(nèi)將抽封的樣品寄往受安標(biāo)中心委托的安全生產(chǎn)檢測(cè)檢驗(yàn)機(jī)構(gòu)。現(xiàn)場(chǎng)評(píng)審不通過(guò)或需要復(fù)評(píng)審,不抽封樣品。
(6)審核發(fā)證:安標(biāo)中心收到產(chǎn)品檢驗(yàn)報(bào)告、現(xiàn)場(chǎng)評(píng)審整改報(bào)告后,根據(jù)綜合審查要求對(duì)申辦產(chǎn)品進(jìn)行審核,綜合審查時(shí)間為5個(gè)工作日,合格的提交安標(biāo)中心有關(guān)領(lǐng)導(dǎo)簽批;在確認(rèn)申請(qǐng)單位交納了各項(xiàng)費(fèi)用后,安標(biāo)中心制作并發(fā)放安全標(biāo)志證書;安全標(biāo)志證書統(tǒng)一由安標(biāo)中心郵寄。證書有效期為4年。對(duì)取得特種勞動(dòng)防護(hù)用品安全標(biāo)志的生產(chǎn)單位由安標(biāo)中心每年進(jìn)行一次審核。取得安全標(biāo)志的企業(yè)及產(chǎn)品等相關(guān)信息,自證書發(fā)放當(dāng)日,通過(guò)安標(biāo)中心網(wǎng)站向社會(huì)公布。
關(guān)于在疫情期間審核發(fā)證程序是否可以加快的問(wèn)題,安標(biāo)中心于2020年2月3日發(fā)布的《關(guān)于做好疫情防控期間特種勞動(dòng)防護(hù)用品安全標(biāo)志服務(wù)工作的公告》提及涉及防疫物資保障的業(yè)務(wù)予以優(yōu)先辦理。經(jīng)筆者電話咨詢安標(biāo)中心,目前疫情期間暫時(shí)取消了現(xiàn)場(chǎng)審核的程序,在完成資料受理和技術(shù)審查以后會(huì)核發(fā)LA標(biāo)志認(rèn)證,等疫情結(jié)束后再補(bǔ)充審核,如果不能通過(guò)現(xiàn)場(chǎng)審核將對(duì)安全標(biāo)志予以取消。申辦程序原則上沒(méi)有簡(jiǎn)化,但因已經(jīng)省去了現(xiàn)場(chǎng)評(píng)審和檢驗(yàn)的程序,實(shí)際上申辦LA標(biāo)志認(rèn)證所需要時(shí)間減少了,約為15個(gè)工作日。需要注意的是網(wǎng)站上暫時(shí)不會(huì)更新公示信息(即企業(yè)的LA標(biāo)志認(rèn)證不能在網(wǎng)上查到),需等疫情結(jié)束后完成現(xiàn)場(chǎng)檢查和產(chǎn)品檢驗(yàn)以后方將更新網(wǎng)上信息。
綜上,若轉(zhuǎn)產(chǎn)非醫(yī)用口罩生產(chǎn),企業(yè)僅需增加相應(yīng)經(jīng)營(yíng)范圍及非強(qiáng)制性地辦理產(chǎn)品認(rèn)證即可,無(wú)其他資質(zhì)門檻。但鑒于疫情防護(hù)期間口罩的生產(chǎn)事關(guān)重大、較為敏感,建議企業(yè)提前和市場(chǎng)監(jiān)督管理局就轉(zhuǎn)產(chǎn)進(jìn)行溝通,配合市場(chǎng)監(jiān)督管理局的相關(guān)工作和檢查。
?
第二部分 開展醫(yī)用口罩生產(chǎn)所需資質(zhì)
?
國(guó)家衛(wèi)健委疾控局推薦的一次性使用醫(yī)用口罩、醫(yī)用外科口罩、醫(yī)用防護(hù)口罩的生產(chǎn)制造受《醫(yī)療器械監(jiān)督管理?xiàng)l例》和《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》及其附錄中對(duì)第二類醫(yī)療器械的有關(guān)規(guī)定管理。依據(jù)前述規(guī)定,生產(chǎn)醫(yī)用口罩的企業(yè),需要有與生產(chǎn)醫(yī)用口罩相適應(yīng)的生產(chǎn)條件和檢驗(yàn)條件,對(duì)技術(shù)標(biāo)準(zhǔn)中明確需達(dá)到“滅菌”標(biāo)準(zhǔn)的口罩,應(yīng)滿足國(guó)家藥品監(jiān)督管理局發(fā)布的《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范無(wú)菌醫(yī)療器械附錄無(wú)菌醫(yī)療器械》對(duì)生產(chǎn)無(wú)菌醫(yī)療器械的有關(guān)規(guī)定。
一、生產(chǎn)醫(yī)用口罩所需的主要證件及申請(qǐng)程序
(一)??向當(dāng)?shù)厥袌?chǎng)監(jiān)督管理局辦理工商變更登記
企業(yè)轉(zhuǎn)產(chǎn)醫(yī)用口罩生產(chǎn)的,需根據(jù)《中華人民共和國(guó)公司法》第十二條的規(guī)定就經(jīng)營(yíng)范圍的改變進(jìn)行工商變更登記,增加“從事II類醫(yī)療器械的生產(chǎn)、銷售”(具體以市場(chǎng)監(jiān)督管理局核定為準(zhǔn))的經(jīng)營(yíng)范圍,企業(yè)需提供變更登記備案申請(qǐng)書、修改后的公司章程、關(guān)于修改公司章程的決議/決定及營(yíng)業(yè)執(zhí)照原件。疫情期間,多地市場(chǎng)監(jiān)督管理局提供應(yīng)急通道以方便企業(yè)辦理。
(二)??申辦醫(yī)療器械注冊(cè)證及醫(yī)療器械生產(chǎn)許可證
根據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》第二十二條的規(guī)定,從事醫(yī)用口罩生產(chǎn)的企業(yè)需持有經(jīng)所在地省級(jí)人民政府食品藥品監(jiān)督管理局審批的醫(yī)療器械注冊(cè)證和醫(yī)療器械生產(chǎn)許可證。
根據(jù)國(guó)家藥品監(jiān)督管理局分別于2018年8月和2019年8月發(fā)布的《國(guó)家藥品監(jiān)督管理局關(guān)于同意開展醫(yī)療器械注冊(cè)人制度試點(diǎn)工作批復(fù)》(國(guó)藥監(jiān)函〔2018〕43號(hào))、《國(guó)家藥監(jiān)局關(guān)于擴(kuò)大醫(yī)療器械注冊(cè)人制度試點(diǎn)工作的通知》((國(guó)藥監(jiān)械注〔2019〕33號(hào)),在醫(yī)療器械注冊(cè)人制度試點(diǎn)區(qū)域(北京、天津、河北、遼寧、黑龍江、上海、江蘇、浙江、安徽、福建、山東、河南、湖北、湖南、廣東、廣西、海南、重慶、四川、云南、陜西(省、自治區(qū)、直轄市)),醫(yī)療器械注冊(cè)證持有人(下稱“注冊(cè)人”)可以將已獲得醫(yī)療器械注冊(cè)證的產(chǎn)品(如醫(yī)用口罩)委托給具備生產(chǎn)能力的一家或者多家企業(yè)生產(chǎn)。因此,我們理解醫(yī)療器械注冊(cè)人制度試點(diǎn)區(qū)域以外地區(qū)的企業(yè)應(yīng)采取模式A開展轉(zhuǎn)產(chǎn)醫(yī)療口罩工作,而符合條件的試點(diǎn)區(qū)域內(nèi)企業(yè)可選擇通過(guò)模式A或模式B開展生產(chǎn)。
1、模式A :自行取得醫(yī)療器械注冊(cè)證、醫(yī)療器械生產(chǎn)許可證開展醫(yī)療口罩的生產(chǎn)及銷售;
2、模式B:與具備《醫(yī)療器械注冊(cè)證》的企業(yè)、研發(fā)機(jī)構(gòu)或個(gè)人合作,由該注冊(cè)人委托企業(yè)生產(chǎn),企業(yè)僅取得醫(yī)療器械生產(chǎn)許可證。
以廣東省(試點(diǎn)區(qū)域之一)為例,在A/B模式下申辦醫(yī)療器械注冊(cè)證和/或醫(yī)療器械生產(chǎn)許可證的要點(diǎn)如下:

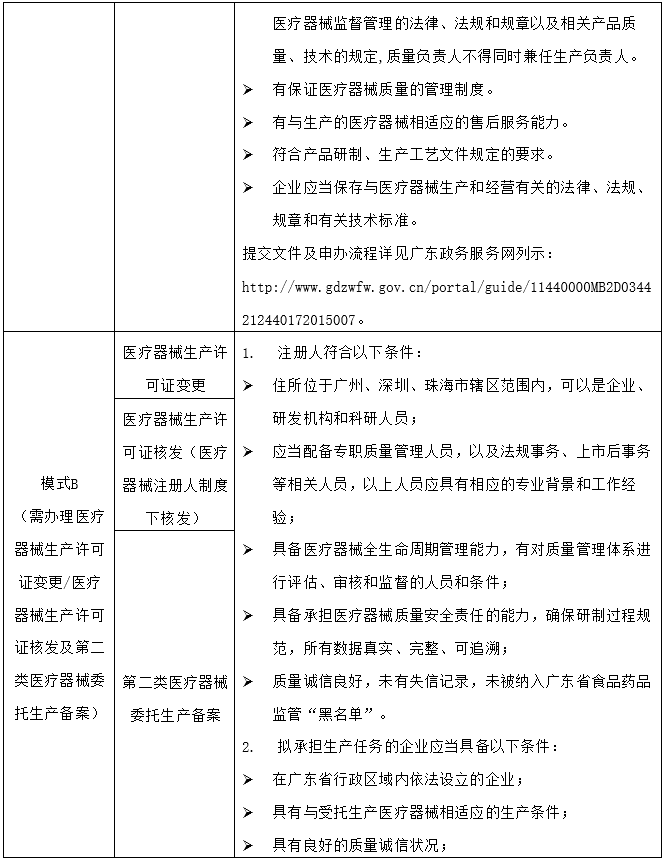

為應(yīng)對(duì)新型冠狀病毒感染的肺炎疫情,在國(guó)家藥品監(jiān)督管理局指導(dǎo)下,多個(gè)省級(jí)藥品監(jiān)管部門已啟動(dòng)醫(yī)療器械應(yīng)急審批程序服務(wù)企業(yè)需求。以廣東省為例,2020年2月1日,廣東省藥品監(jiān)督管理局(下稱“廣東省藥監(jiān)局”)公布《廣東省防控新型冠狀病毒感染的肺炎疫情所需藥品醫(yī)療器械行政許可應(yīng)急審批程序》,對(duì)防控新型冠狀病毒感染的肺炎疫情應(yīng)急所需且在省內(nèi)尚無(wú)同類產(chǎn)品上市,或雖在省內(nèi)已有同類產(chǎn)品上市,但產(chǎn)品供應(yīng)不能滿足防控疫情應(yīng)急處理需要的口罩防護(hù)服等藥品醫(yī)療器械,納入應(yīng)急審批,應(yīng)急許可審批事項(xiàng)包括第二類醫(yī)療器械注冊(cè)審批、藥品醫(yī)療器械生產(chǎn)經(jīng)營(yíng)許可等。申請(qǐng)應(yīng)急審批行政許可事項(xiàng)的企業(yè),應(yīng)按照“告知承諾制”提出申請(qǐng),并在所申請(qǐng)行政許可事項(xiàng)中標(biāo)注“申請(qǐng)應(yīng)急審批”。企業(yè)擬采取應(yīng)急審批通道的,應(yīng)當(dāng)在申請(qǐng)前將產(chǎn)品應(yīng)急所需的情況事先告知廣東省藥監(jiān)局,廣東省藥監(jiān)局將及時(shí)介入,并指導(dǎo)申請(qǐng)人開展相關(guān)申報(bào)工作。廣東省藥監(jiān)局對(duì)符合應(yīng)急審批要求的第二類醫(yī)療器械注冊(cè)將在10日內(nèi)完成審批,對(duì)醫(yī)療器械生產(chǎn)許可證變更申請(qǐng)將在5日內(nèi)完成審批,同時(shí)還可附條件審批。
對(duì)于僅在疫情期間臨時(shí)轉(zhuǎn)產(chǎn),疫情結(jié)束后將復(fù)產(chǎn)的企業(yè),廣東省亦有相關(guān)政策支持。筆者經(jīng)電話咨詢廣東省藥監(jiān)局,該局已在疫情防控期間下發(fā)《廣東省藥品監(jiān)督管理局辦公室關(guān)于重大突發(fā)公共衛(wèi)生事件一級(jí)響應(yīng)期間對(duì)醫(yī)用口罩等防控急需用器械實(shí)施特殊管理的通知》(粵藥監(jiān)辦許〔2020〕39號(hào))和《廣東省藥品監(jiān)督管理局辦公室關(guān)于一級(jí)響應(yīng)期間對(duì)醫(yī)用口罩等防控急需用品實(shí)施特殊管理的補(bǔ)充通知》(粵藥監(jiān)辦許〔2020〕42號(hào)),雖然上述文件均為內(nèi)部文件,筆者無(wú)法查看,但根據(jù)廣東省藥監(jiān)局工作人員的口頭回復(fù),在一級(jí)響應(yīng)期間,廣東省藥監(jiān)局將應(yīng)急醫(yī)療器械產(chǎn)品/生產(chǎn)/委托生產(chǎn)備案的權(quán)限下放到各市局,擬臨時(shí)轉(zhuǎn)產(chǎn)醫(yī)用口罩的企業(yè)可以通過(guò)當(dāng)?shù)厥屑?jí)市場(chǎng)監(jiān)督管理局進(jìn)行應(yīng)急醫(yī)療器械產(chǎn)品備案、應(yīng)急醫(yī)療器械生產(chǎn)備案或應(yīng)急醫(yī)療器械委托生產(chǎn)備案,以開展醫(yī)用口罩的生產(chǎn)經(jīng)營(yíng)。該等應(yīng)急備案僅在疫情期間有效,如轉(zhuǎn)產(chǎn)企業(yè)在疫情結(jié)束后仍計(jì)劃延續(xù)醫(yī)用口罩生產(chǎn)的,需重新向省級(jí)藥品監(jiān)督管理局申請(qǐng)行政許可。
以中山為例:根據(jù)中山市市場(chǎng)監(jiān)督管理局于1月30日發(fā)布的《中山市突發(fā)公共衛(wèi)生事件一級(jí)響應(yīng)期間應(yīng)急醫(yī)療器械產(chǎn)品備案指引》、《中山市突發(fā)公共衛(wèi)生事件一級(jí)響應(yīng)期間應(yīng)急醫(yī)療器械生產(chǎn)備案指引》、《中山市突發(fā)公共衛(wèi)生事件一級(jí)響應(yīng)期間應(yīng)急醫(yī)療器械委托生產(chǎn)備案指引》,在一級(jí)響應(yīng)期間,企業(yè)臨時(shí)轉(zhuǎn)產(chǎn)醫(yī)用口罩在兩種經(jīng)營(yíng)模式下需要提交的材料及辦理時(shí)限分別如下:

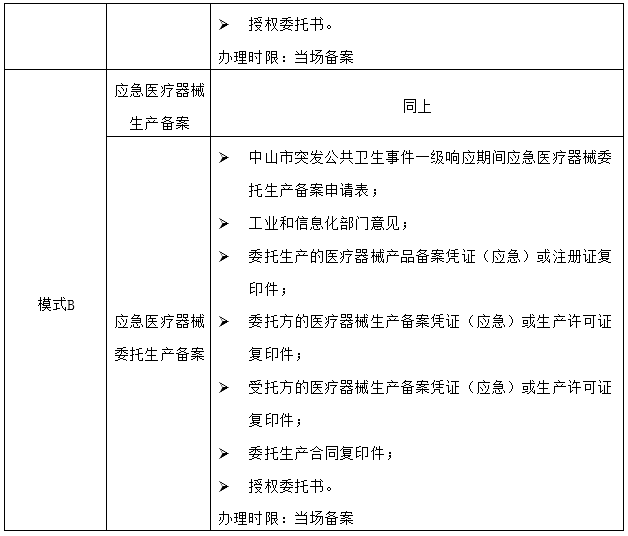
鑒于中山市發(fā)布的三份備案指引均依據(jù)廣東省藥監(jiān)局《廣東省藥品監(jiān)督管理局辦公室關(guān)于重大突發(fā)公共衛(wèi)生事件一級(jí)響應(yīng)期間對(duì)醫(yī)用口罩等防控急需用器械實(shí)施特殊管理的通知》(粵藥監(jiān)辦許〔2020〕39號(hào))和《廣東省藥品監(jiān)督管理局辦公室關(guān)于一級(jí)響應(yīng)期間對(duì)醫(yī)用口罩等防控急需用品實(shí)施特殊管理的補(bǔ)充通知》(粵藥監(jiān)辦許〔2020〕42號(hào)),因此,廣東省其他地區(qū)在一級(jí)響應(yīng)期間應(yīng)有類似政策,建議企業(yè)咨詢當(dāng)?shù)厥屑?jí)市場(chǎng)監(jiān)督管理局。
綜上,醫(yī)用口罩的生產(chǎn)許可在正常情況下具備較高的申請(qǐng)門檻且耗時(shí)較久,但在抗疫期間可通過(guò)綠色通道得到快速辦理,且臨時(shí)生產(chǎn)企業(yè)的審批權(quán)限已下放至地市,有助于企業(yè)在疫情防疫緊急期間更快啟動(dòng)相應(yīng)生產(chǎn)。
結(jié)合實(shí)際,筆者建議原先并非從事類似行業(yè)的企業(yè)若有意轉(zhuǎn)產(chǎn)口罩,可考慮先行啟動(dòng)非醫(yī)用顆粒物防護(hù)口罩的生產(chǎn),后續(xù)是否啟動(dòng)難度更大的醫(yī)用口罩生產(chǎn)證照之申請(qǐng)則視企業(yè)具體情況及規(guī)劃而定。支援國(guó)家的同時(shí),轉(zhuǎn)產(chǎn)或許也能給傳統(tǒng)企業(yè)帶去解決產(chǎn)能過(guò)剩、尋求新商機(jī)新合作之機(jī)遇。
?
?
????????????????????????????????????????????????????????????????????????????????????????????????????????????? 廣東省粵港澳合作促進(jìn)會(huì)法律專業(yè)委員會(huì)
? ? ? ? ? ? ? ? ? ???????????????????????????????????????????????????????????????????????????????????????????????? ?2020年2月7日
?
執(zhí)筆人:楊閏,廣東省粵港澳合作促進(jìn)會(huì)法律專業(yè)委員會(huì)律師、北京德恒(廣州)律師事務(wù)所合伙人,13312840201, yangrun@dehenglaw.com
??????????????楊丹鳳,北京德恒(廣州)律師事務(wù)所律師,17688391859, yangdf@dehenglaw.com
?
?
鳴謝:廣東省工商聯(lián)應(yīng)對(duì)新型冠狀病毒感染的肺炎疫情律師志愿服務(wù)團(tuán)
注:?本解讀由志愿團(tuán)律師根據(jù)其對(duì)法律的了解作出,代表其個(gè)人、非正式意見,僅供企業(yè)了解資訊所用,不作為正式法律意見。具體法律問(wèn)題需根據(jù)實(shí)際情況進(jìn)行判斷。
?